產后溶血性尿毒癥綜合征診治進展
彭雪、吳釗、彭冰,四川大學華西第二醫院出生缺陷與相關婦兒疾病教育部重點實驗室 四川省醫學科學院四 川省人民醫院
溶血性尿毒癥綜合征(hemolytic uremic syndrome, HUS)主要臨床表現為“三聯征”,即非免疫性(Coombs 實驗陰性)微血管病性溶血性貧血、血小板減少和急 性腎功能衰竭[1]。HUS 又根據其病因不同分為“典 型”和“型”兩類[1]。產后溶血性尿毒癥綜合征 (postpartum hemolytic uremic syndrome,PHUS)是 型 HUS 中的一種,與妊娠密切相關,因大部分病例于產 后 10 周內發生不可逆急性腎功能衰竭伴血小板減少、 微血管病性貧血[2],也稱為產后自發性腎功能衰竭,發 病率約為 1/25000,少數病例也可于妊娠晚期發生,且 有約 23%的孕婦可繼發嚴重腎臟功能損害[3]。60% ~ 70%的 PHUS 可發展為終末期腎病,預后極差[3, 4 ] 。
2006 年歐洲兒科學組將 HUS 和血栓性血小板減 少性紫癜(thrombotic thrombocytopenic purpura,TTP)兩 個不同的臨床綜合征因其共同的病理基礎,均歸入血栓 性微血管疾病(thrombotic microangiopathies,TMA)[5]。 典型性 HUS 又叫“腹瀉型 HUS”,常見于感染大腸埃希 菌 O157 ∶ H7 的兒童。志賀毒素是導致大腸埃希菌相 關 HUS 血管內皮損傷的主要原因。型性 HUS 被 定義為“一切非志賀毒素感染所致 HUS”,誘因包括如 肺炎鏈球菌、HIV 病毒等感染性疾病,以及惡性腫瘤、放 化療、、免疫劑或抗血管內皮生長因子等 藥物的使用,還有妊娠、HELLP 綜合征、惡性高血 壓、免疫系統疾病、遺傳因素等。目前研究認為,其發病 的病理生理機制為原發性或繼發性補體系統調節異常。 型 HUS 的發病率占 HUS 的 5%~10%,其死亡率在 2%~10%,約 1/3 患者可迅速發展為終末期腎病[1]。
PHUS 是屬于型 HUS 中的一種,臨床罕見,若未及 時診斷和處理,預后極差。
PHUS 屬于型 HUS,目前研究表明 PHUS 的 發病機制可能與以下因素有關。
目前研究已證明,PHUS 與各種原因 誘發補體旁途徑(alternative complement pathway)調 節失控、過度激活有關[6, 7 ],若編碼補體調節關鍵蛋白 如 CFH、MCP、CFI、C3 等基因突變或存在相關血漿抗體 如抗補體因子 H 抗體可導致該人群對 PHUS 易感[8]。 誘發因素包括感染、藥物、腫瘤、妊娠、子癇前期、母胎輸 血、免疫系統疾病等。根據補體基因突變類型可對 PHUS 進行分類為CFH-HUS、MCP-HUS、CFI-HUS、C3-HUS 和抗 補體因子 H 抗體-HUS 等亞型。已知妊娠期母體補體系 統處于應激狀態[9],而對于基因缺陷人群其補體激活產 物將持續大量生成,補體異常激活可導致彌漫性血管內 皮損傷、血小板與纖維蛋白聚集消耗、微血栓形成、繼發 機械性溶血、終末器官缺血與功能損傷[1, 10]。
研究,PHUS 與遺傳因素有關, 兒童 HUS 多為常染色體遺傳, HUS 多為常 染色體顯性遺傳,女性好發。遺傳性 PHUS 多伴有惡 性高血壓,預后極差。研究發現,妊娠晚期血管性血 友病因子裂解蛋白酶 ADAMTS13(vWF 裂解蛋白酶) 濃度降低或顯著降低可明顯增加發生 PHUS 和 TTP 的風險[8]。一些 PHUS 患者還存在遺傳性 HF1 基因 缺失或 MCP 基因突變[2]。
妊娠期凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅷ、 Ⅸ、Ⅸ及血液中纖維蛋白原等均增加,孕婦血液處于高凝狀態。當出現產科合并癥或并發癥,如妊娠期高血 壓、子癇前期、子癇、HELLP 綜合征、感染、胎盤早剝、產后 出血、羊水栓塞、彌散性血管內凝血(DIC)等,易導致凝血 功能異常,誘發腎血管痙攣、微血栓形成,嚴重時導致腎 小管、甚至腎皮質缺血壞死,最終影響腎臟功能。
一些患者發病前可出現胃腸道或泌 尿系統不適癥狀,有研究者認為細菌毒素或病毒可通 過胃腸道或泌尿道進入機體,引起腎臟血管內凝血反 應。在產褥期,腎臟更易受累,導致 PHUS。 PHUS 的主要病理特征是血管內皮細胞損傷后引 起微動脈和毛細血管內微血栓形成。腎臟是主要受累 器官,活檢時顯示腎小球毛細血管和小動脈內有廣泛微 血栓形成,毛細血管管腔內充滿破碎的紅細胞和血小板。 微血栓栓子主要由血小板和纖維蛋白組成,可導致靶器 官的缺血梗死。微血栓栓子形成的具體機制可能與血漿 中存在異常的促血小板聚集因子(如 vWF 因子)或缺乏 正常的血小板聚集因子(如前列腺環素等)相關[11]。
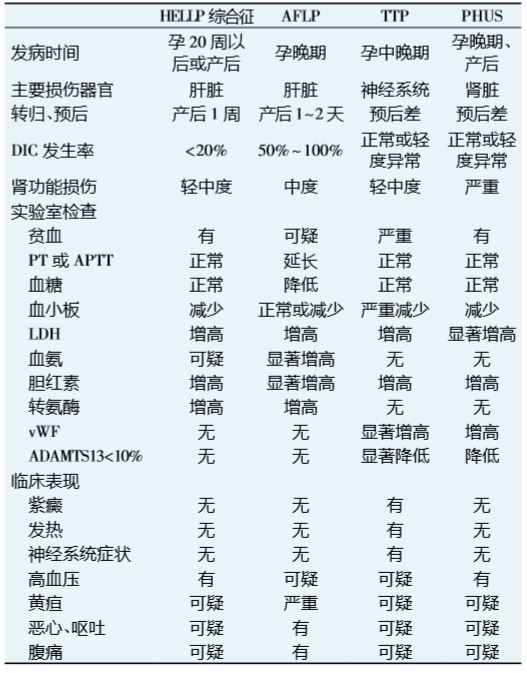
早期診斷和及時治療可以明顯改善 PHUS 患者 預后。但由于 PHUS 與重度子癇前期、HELLP 綜合 征、TTP、妊娠期急性脂肪肝(AFLP)等在臨床表現上 極為相似,且這些綜合征或并發癥可能先后發生或相 互重疊,導致臨床診斷非常困難。 PHUS 患者主要于妊娠晚期或產后 10 周內發病, 多 數合并有妊娠期高血壓、子癇前期、子癇、HELLP 綜合征、 感染、胎盤早剝、產后出血等妊娠合并癥或并發癥。部分 患者在起病前有一系列非性前驅癥狀,包括惡心、 嘔 吐、腹痛、腹瀉、發熱、頭痛、無力等不適,隨之出現高血 壓、水腫、黃疸,并迅速發展為急性腎功能衰竭。典型者 表現為發熱、少尿或無尿、血尿和血紅蛋白尿、急劇進展 的氮質血癥,同時伴有進行性加重的微血管溶血性貧血 或消耗性血小板減少等,病情發展急劇。少數患者還可 出現腎外表現,包括中樞神經系統癥狀,如頭痛、抽搐、 癲 癇發作、昏迷等,常伴心力衰竭、肺水腫等多臟器衰竭。 實驗室檢查通常提示:周圍血涂片有形態不規則 的破碎紅細胞(破碎紅細胞比例>1%),網織紅細胞增 多;血紅蛋白進行性下降,可降至 60 g/L 或更低;血小 板計數<100×109 /L,形態與功能異常;黃疸指數及血 清膽紅素增高(以間接膽紅素增高為主),乳酸脫氫酶 (LDH)增高,血漿白蛋白降低;纖維蛋白原減少,纖維 蛋白降解產物增高;凝血酶原時間(PT)、凝血酶及活 化部分凝血活酶時間( APTT) 延長;直接或間接 Coombs 試驗陰性;血清尿素氮、肌酐升高;肌酐清除率 下降;隨機尿出現大量蛋白尿、血尿、病理管型等。 最新研究已證明,PHUS 與各種原因誘發補體旁途徑調節失控、過度激活有關,國外文獻報道,通過 相關補體基因突變檢測發現,近 10%的子癇前期或 HELLP 綜合征患者有陽性結果[12],提示 PHUS 極易 被誤診為上述疾病[10],故國外文獻推薦對高危人群或 可疑患者應常規開展針對補體旁途徑的相關基因 和檢測,有助于對該疾病的確切診斷和鑒別診 斷。推薦篩查的具體突變基因包括 CFH、MCP、CFI、 CFB 和 C3 基因,推薦檢測的相關包括 vWF、ADAMTS 13、C3 和 C4[13]。例如,血漿中 ADAMTS 13 的 活性檢測在 TTP 和 PHUS 的鑒別診斷中非常重要, ADAMTS 13 活性嚴重降低(<10%)對于 TTP 有極高 的陽性預測值(85%~98%)[14, 15]。 由于目前的實驗室檢查僅能確診 40% ~ 75%的 PHUS 患者,且實驗室檢測需要花費數周甚至數月的 時間,因此 PHUS 的臨床診斷更為重要[10, 15]。對于妊 娠晚期或產后數天至 10 周內發生的以微血管病性溶血 性貧血、血小板減少和急性腎功能衰竭為主要表現的患 者,尤其以腎臟損傷為突出表現者,需高度 PHUS, 盡快啟動診斷性治療,同時結合相關實驗室檢查、 性基因和檢測有助于明確診斷與鑒別診斷。 子癇前期、HELLP 綜合征等患者通常在終止妊娠后 病情可得到迅速緩解,且上述疾病也是 PHUS 易感人群 的誘發因素之一,如果在終止妊娠 1 周內癥狀無自限或 好轉,且出現腎臟功能進行性損害,結合實驗室檢查應診 斷 PHUS。具體相關疾病的診斷與鑒別診斷要點見表 1。
目前,PHUS 尚無特效的治療方法。近年來,國外 研發的性抗補體治療已對該類疾病的長期治 療有效。然而,盡早開始血液透析、血漿置換或輸注新 鮮冰凍血漿等治療有助于緩解急性腎臟功能衰竭,可明 顯改善 PHUS 患者的預后和提高率,目前仍然是首 選的治療方法。對 PHUS 的治療強調多學科團隊的綜 合治療和長期隨診,治療團隊應包括母胎醫學專家、重 癥醫學專家、血液學專家和輸血醫學專家等[13]。
為 PHUS 首選的治療方法,國外文獻推 薦在確診或疑診 PHUS 的24 小時內盡早開始透析治療, 甚至可先于實驗室 PHUS 相關基因或檢測結果[13]。 有研究認為,腹膜透析因其對血流動力學、心血管系統影 響小,以及可避免肝素化,從而降低腹部切口和子 宮出血的風險,故在 PHUS 治療中可作為首選[15, 16]。 然而,對少尿或無尿、尿素和肌酐進行性升高、血鉀≥ 6 mmol/L、嚴重代謝性酸中毒、水鈉潴留引起心衰、肺 水腫或腦水腫、以及持續性血壓升高者應盡早進行血 液透析治療,使患者更易度過急性腎功能衰竭期[2]。
血漿置換應結合透析治 療盡早進行,特別針對嚴重溶血、有出血傾向以及腎 功能嚴重損害者均為血漿置換的適應證[13]。通過血 漿置換可有效清除血漿里的有害物質、異常補體成分 等,以及及時補充必要的凝血因子和血小板聚集 因子等。具體方法尚無統一標準,但有相關文獻推 薦:PHUS 患者置換血漿每次 2~4 L,開始時每天置換 1 次,置換 3~4 次后改為隔日 1 次或每周 2 次直至患 者病情持續穩定[2]。國外文獻還推薦為降低輸血相 關肺損傷的風險,可選擇使用來自男性捐獻者的混合 血漿,但尚不充分。血漿置換的治療方案或時限 應根據患者的治療效果制定個體化方案,通常應持續 治療至患者相關血液學指標完全正常,包括血小板恢 復至 150×109 /L 以上,以及 LDH 降至正常水平[13]。 無血漿置換條件也可輸注新鮮冰凍血漿,可在一定程 度上緩解病情。具體方法尚無統一標準,但有文獻推 薦:初始劑量為400 ml/d,連續使用1~2 周后改為200 ml/d,隔日 1 次,直至病情緩解[2]。嚴重貧血者可輸 濃縮紅細胞糾正貧血。
有文獻報道[10, 13],腎上腺皮質 激素適合于治療輕度 PHUS 患者或作為輔助治療方 法之一,但治療劑量宜大,如潑尼松每日 1~2 mg/kg, 直至病情緩解,治療有效率為 10%~50%。
近年來國外 Alexion 公司研 發的人重組單克隆抗體 Eculizumab(商品名 Soliris)是 一種補體性劑,因其對補體介導的血栓性微血管病(TMA)和腎功能改善的有效性,并在諸多 臨床前瞻性試驗中對患者的明顯效益,美國 FDA 和歐洲 CHMP 已批準并推薦其作為一線用藥用于治 療型 HUS[13, 17]。因此,在 PHUS 的診斷性治療方 案中,抗補體治療(eculizumab)應盡早開始[18, 19]。但 此藥十分昂貴,且需患者長期用藥,每人每年需花費 約 409500 美元。該藥尚未在中國批準上市,國內亦 無相關文獻報道。 4. 5 終止妊娠時機 PHUS 可在妊娠晚期發生,但目 前尚無相關指南或專家共識明確妊娠期患者終止妊 娠的時機,且國內外相關文獻極少。國外有學者認 為,妊娠期如診斷型 HUS 應盡快終止妊娠[20]。 妊娠大于 33 周應給予地塞米松促胎肺成熟治療后, 盡快以剖宮產終止妊娠。妊娠 32~33 周可先進行血 液透析和血漿置換,同時予促胎肺成熟治療,待病情 改善后行剖宮產終止妊娠。妊娠小于 31 周者應盡快 終止妊娠,同時進行血液透析、血漿置換等治療。 PHUS 如治療不及時死亡率極高。由于 PHUS 患 者體內補體系統的持續異常激活和不可逆的腎臟功 能損傷,即使短期內病情已得到有效緩解,但仍需長 期治療和隨訪[21]。據統計,PHUS 導致急性腎功能衰 竭患者中有 60%在 1 年內可發展為終末期腎病,甚至 因慢性多器官功能衰竭或并發癥導亡[22]。另外, 根據型 HUS 不同亞型的預后研究發現,CFHHUS 預后最差,死亡率高達 20%~50%,CFI-HUS 患者 中有 50%可進展至終末期腎病,而大部分 MCP-HUS 患者的腎臟功能可逆,如果治療及時,抗補體因子 H 抗體-HUS 亞型的患者預后最佳[3]。