高中化學平衡移動不會?這份最全知識總結你需要看看!
化學知識點多而零碎,在學習過程中若不能融會貫通,尤其是一些“特殊”之處,往往致使解題陷人“山重水復”之境。為了理解、鞏固和掌握這些知識,消除盲點。今天小編給同學們準備了化學平衡相關知識點的總結,趕快來收藏哦!
(1)溫度:在其他條件不變的情況下,升高溫度,化學平衡向吸熱反應方向移動;降低溫度,化學平衡向放熱反應方向移動。
(2)濃度:在其他條件不變的情況下,增大反應物濃度或減小生成物濃度,化學平衡向正反應方向移動;減小反應物濃度或增大生成物濃度,化學平衡向應方向移動。
(3)壓強:對于反應前后總體積發生變化的化學反應,在其他條件不變的情況下,增大壓強,化學平衡向氣體體積減小的方向移動;減小壓強,化學平衡向氣體體積增大的方向移動。
(4)催化劑:由于催化劑能同時同等程度地增大或減小正反應速率和應速率,故其對化學平衡的移動無影響。
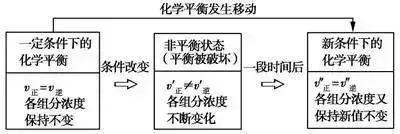
在密閉體系中,如果改變影響化學平衡的一個條件(如溫度、壓強或濃度等),平衡就向能夠減弱這種改變的方向移動。
在一定條件下,濃度、壓強、溫度、催化劑等因素會影響可應的速率,但平衡不一定發生移動,只有當v正≠v逆時,平衡才會發生移動。
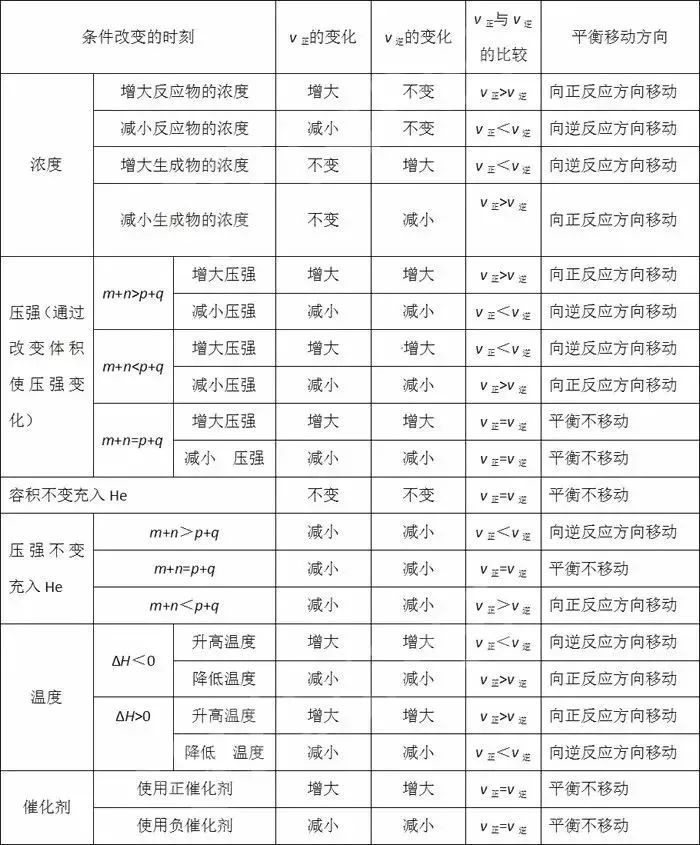
(3)對于反應前后氣體體積無變化的反應,如H2(g)+I2(g)2HI(g),壓強的改變對平衡無影響。但增大(或減小)壓強會使各物質的濃度增大(或減小),混合氣體的顏色變深(或淺)。
(4)恒容時,同等程度地改變反應混合物中各物質的濃度時,應視為壓強的影響,增大(減小)濃度相當于增大(減小)壓強。
(5)在恒容容器中,當改變其中一種氣態物質的濃度時,必然會引起壓強的改變,在判斷平衡移動的方向和物質的率、體積分數變化時,應靈活分析濃度和壓強對化學平衡的影響。若用α表示物質的率,φ表示氣體的體積分數,則:
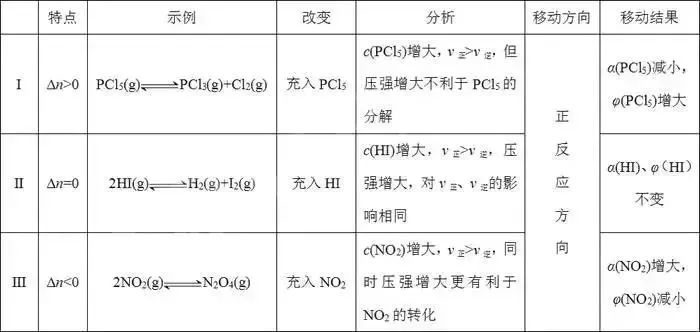
①對于A(g)+B(g)C(g)類反應,達到平衡后,保持溫度、容積不變,加入一定量的A,則平衡向正反應方向移動,α(B)增大而α(A)減小,φ(B)減小而φ(A)增大。
②對于aA(g)bB(g)或aA(g)bB(g)+cC(g)類反應,達到平衡后,保持溫度、容積不變,加入一定量的A,平衡移動的方向、A的率變化,可分以下三種情況進行分析:
化學平衡圖象類試題是高考的熱點題型,該類試題經常涉及到的圖象類型有物質的量(濃度)、速率—時間圖象,含量—時間—溫度(壓強)圖象,恒溫、恒壓曲線等,圖象中蘊含著豐富的信息量,具有簡明、直觀、形象的特點,命題形式靈活,難度不大,解題的關鍵是根據反應特點,明確反應條件,認真分析圖象充分挖掘蘊含的信息,緊扣化學原理,找準切入點解決問題。該類題型在選擇題和簡答題中都有涉及,能夠很好地考查學生分析問題和解決問題的能力,在復習備考中應引起足夠的重視。

(曲線a用催化劑,b不用催化劑或化學計量數a+b=c時曲線a的壓強大于b的壓強)

(2)恒壓(溫)線(如圖所示):該類圖象的縱坐標為物質的平衡濃度(c)或反應物的率(α),橫坐標為溫度(T)或壓強(p),常見類型如下所示:

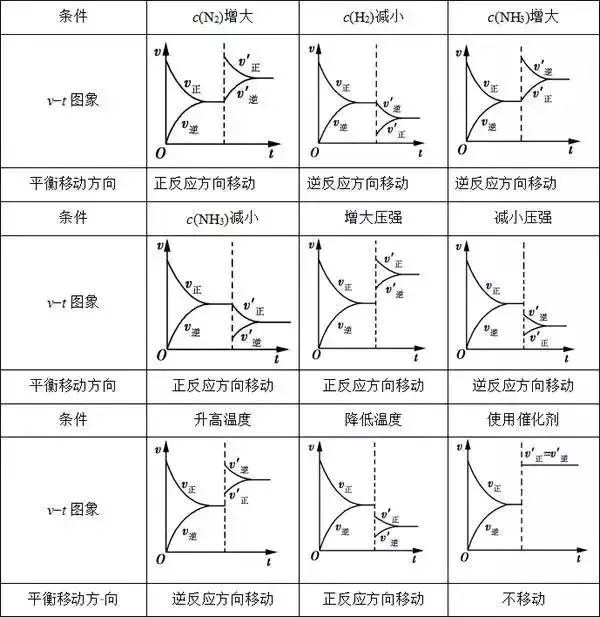
根據v−t圖象,可以很快地判斷出反應進行的方向,根據v正、v逆的變化情況,可以推斷出條件的改變情況。
如下圖所示曲線,是其他條件不變時,某反應物的最大率(α)與溫度(T)的關系曲線四個點,v(正)v(逆)的點是3,v(正)v(逆)的點是1,v(正)=v(逆)的點是2、4。
在化學平衡圖象中,包括縱坐標、橫坐標和曲線所表示的意義三個量,確定橫坐標所表示的量后,討論縱坐標與曲線的關系或確定縱坐標所表示的量,討論橫坐標與曲線的關系。如圖:
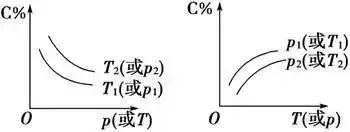
這類圖象的分析方法是“定一議二”,當有多條曲線及兩個以上條件時,要固定其中一個條件,分析其他條件之間的關系,必要時,作一輔助線)“先拐先平,數值大”原則
在化學平衡圖象中,先出現拐點的反應先達到平衡,先出現拐點的曲線表示的溫度較高(如圖A)或表示的壓強較大(如圖B)。
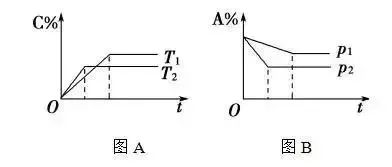
圖B表示p1p2,A是反應物,正反應為氣體總體積縮小的反應,即a+bc。
(2)對于同一可應,在一定條件(恒溫恒容或恒溫恒壓)下,無論是從正反應(反應物)、應(生成物)或從中間狀態(既有反應物、也有生成物)開始,只要建立平衡后,平衡混合物中各組分的比例相同,或各組分在混合物中的百分含量相等,這樣的化學平衡互稱為等效平衡。
(3)注意只是組分的百分含量相同,包括體積百分含量、物質的量百分含量或質量百分含量,而各組分的濃度不一定相等。
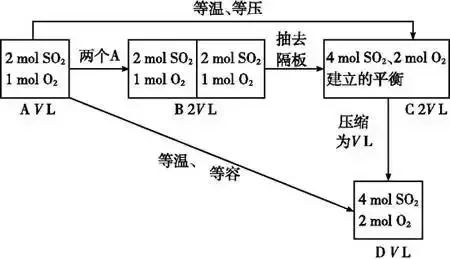
理解等效平衡的意義(1)對于反應前后氣體物質的量有變化的反應,如2SO2(g)+O2(g)
容易得出A與C等效,A與D不等效。因為C→D是對反應前后氣體體積有變化的反應加壓,平衡發生了移動。
(2)對于反應前后氣體物質的量沒有變化的反應,如:H2(g)+I2(g)
容易得出A與C等效,A與D等效。因為C→D平衡不發生移動。對反應前后氣體體積不變的反應加壓,平衡不移動。


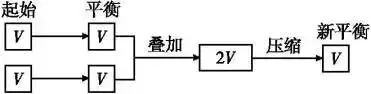
在解題時若遇到比較條件改變后的新、舊平衡間某量的關系有困難時,可以考慮構建一個與舊平衡等效的“虛擬的第三平衡”,然后通過壓縮或擴大體積等手段,再與新平衡溝通,以形成有利于問題解決的新模式,促使條件向結論,例如:
(1)構建等溫等容平衡思維模式:新平衡狀態可認為是兩個原平衡狀態簡單的疊加并壓縮而成,相當于增大壓強。
(2)構建等溫等壓平衡思維模式(以氣體物質的量增加的反應為例(見圖示):新平衡狀態可以認為是兩個原平衡狀態簡單的疊加,壓強不變,平衡不移動。

聲明:該文觀點僅代表作者本人,搜狐號系信息發布平臺,搜狐僅提供信息存儲空間服務。