高二化學(xué)入不了門形象逐漸妖救救孩子!
經(jīng)過了初中一年對化學(xué)的了解,進(jìn)入高中階段,面對如此繁雜又看不懂的世界,該如何學(xué)好高中化學(xué),打好化學(xué)基礎(chǔ)這場戰(zhàn)役呢?
當(dāng)然,了解它,知此知彼,方能有可能戰(zhàn)勝它。同時(shí)轉(zhuǎn)變學(xué)習(xí)方法:從思想上重視,加強(qiáng)學(xué)習(xí)的主動性;從氣場上,相信自己可以玩轉(zhuǎn)它;行動上積極,認(rèn)真聽勤加與總結(jié)。如此,便可取得最終的勝利。

(2)理論性增強(qiáng)初中教材注重基礎(chǔ),而高中階段更加抽象,理論性也更強(qiáng),均需要在理解后才會做題。要求對知識點(diǎn)的理解與融會貫通。如物質(zhì)的量相關(guān)課題,該部分為整個(gè)高中化學(xué)的基礎(chǔ),重在通過新的物理量了解化學(xué)變化中微觀粒子的變化。
(3)系統(tǒng)性增強(qiáng)高中教材由于理論性增強(qiáng),常以某些基礎(chǔ)理論為綱,根據(jù)一定的邏輯,把基本概念、基本原理、基本方法聯(lián)結(jié)起來。構(gòu)成一個(gè)完整的知識體系。前后知識的關(guān)聯(lián)是其一個(gè)表現(xiàn)。另外,知識結(jié)構(gòu)的形成是另一個(gè)表現(xiàn),因此高中教材知識結(jié)構(gòu)化明顯升級。這就要求在學(xué)習(xí)完一個(gè)章節(jié)后善于歸納總結(jié),找出知識體系間的關(guān)系,使得知識在自己頭腦中形成一個(gè)網(wǎng)絡(luò)關(guān)系圖。
(4)綜合性增強(qiáng)學(xué)科間知識相互滲透,相互為用,加深了學(xué)習(xí)難度。比如計(jì)算部分要求大量的數(shù)學(xué)基礎(chǔ)。
關(guān)于氧化還原反應(yīng)的配平,歷年來各地高考題幾乎都有一道,而且分值是單個(gè)填空題中最大的,一般直接3分。
同時(shí),離子反應(yīng)式,反應(yīng)熱的計(jì)算,酸堿中和計(jì)算等知識點(diǎn)全部依托于氧化還原反應(yīng)配平,故高考中化學(xué)涉及氧化還原反應(yīng)配平的分值約20分,比重較大,必須掌握。
但很多人被氧化還原的知識搞蒙了,什么氧化劑,氧化性,完全氧化還原,部分氧化還原等等很多相似相對應(yīng)的知識點(diǎn),完全聽不懂,又怎么去配平氧化還原反應(yīng)呢!其實(shí)不然,對于氧化還原反應(yīng),你只需要知道常見的化合價(jià),就可以輕松的在四步內(nèi)配平方程式。


化合價(jià)標(biāo)完后,找出其化合價(jià)發(fā)現(xiàn)變化的元素。對于那個(gè)反應(yīng),反應(yīng)前后明顯只有硫元素化合價(jià)發(fā)生了變化。那我們就從氧化產(chǎn)物(化合價(jià)升高對應(yīng)的產(chǎn)物,即K2S03),和還原產(chǎn)物(化合價(jià)降低對應(yīng)的產(chǎn)物,即K2S)著手開始配平,即選擇氧化產(chǎn)物和還原產(chǎn)物作為基準(zhǔn)。以化合價(jià)變化值(取正值)剩以元素原子下標(biāo),標(biāo)出得失電子數(shù)。

K2S中硫元素從0價(jià)降到-2價(jià),降了2個(gè)價(jià)態(tài)剩以1,而K2SO3中硫元素從0價(jià)升到+4價(jià),升了4個(gè)價(jià)態(tài)剩以1,分別列2和4。列變化是四步中最重要的一步,情況比較多。但只要認(rèn)準(zhǔn)氧化產(chǎn)物和還原產(chǎn)物,以它們作為基準(zhǔn),本質(zhì)都不變。
氧化還原反應(yīng)的本質(zhì)是得失電子,并且得失電子守恒。根據(jù)得失電子守恒,我們就可以先配出氧化產(chǎn)物和還原產(chǎn)物的系數(shù),原則就是乘上最小公倍數(shù)。
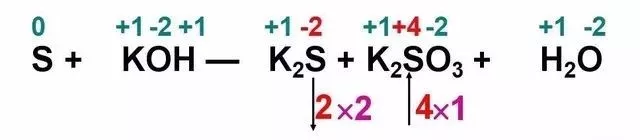
即K2S的系數(shù)為2,K2SO3的系數(shù)為1,再根據(jù)原子守恒,則S前配3,KOH前配6,H20前配3。這個(gè)方程式就配好了。

最后,一個(gè)氧化還原反應(yīng)就配平了。多多的話化學(xué)還是很親切的。返回搜狐,查看更多
- 標(biāo)簽:高中化學(xué)基本常識
- 編輯:馬可
- 相關(guān)文章